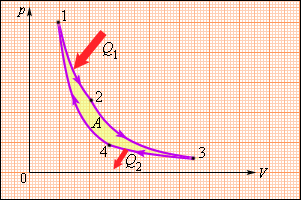
На рисунке представлен прямой цикл тепловой машины
Устройство, имеющее способность преобразовывать полученную теплоту в механическую работу носит название теплового двигателя. В таких машинах механическая работа совершается в процессе расширения вещества, называющегося рабочим телом. Его роль обычно исполняют газообразные вещества, вроде паров бензина, воздуха и водяного пара.
Определение 1
Рабочее тело приобретает или отдает тепловую энергию при теплообмене с телами, которые имеют внушительный запас внутренней энергии. Такие тела называют тепловыми резервуарами.
Исходя из первого закона термодинамики, можно сделать вывод, что полученное газом количество теплоты Q полностью преобразуется в работу A в условиях изотермического процесса, при котором внутренняя энергия не претерпевает изменений (ΔU=0):
A=Q
Однако, подобный однократный акт превращения теплоты в работу для техники не представляет интереса. Существующие тепловые двигатели, такие как паровые машины, двигатели внутреннего сгорания и им подобные, работают циклически. Необходимо периодическое повторение процесса теплопередачи и преобразования полученной теплоты в работу. Чтобы данное условие выполнялось, рабочее тело должно совершать круговой процесс или же термодинамический цикл, при котором исходное состояние с периодически восстанавливается. На рисунке 3.11.1 в виде диаграммы (p, V) газообразного рабочего тела с помощью замкнутых кривых проиллюстрированы круговые. В условиях расширения газ производит положительную работу A1, эквивалентную площади под кривой abc. При сжатии газ совершает отрицательную работу A2, равную по модулю площади под кривой cda. Полная работа за цикл A=A1+A2 на диаграмме (p, V) равняется площади цикла. Работа A положительна, в том случае, если цикл проходит по часовой стрелке, и A отрицательна, когда цикл проходит в противоположном направлении.
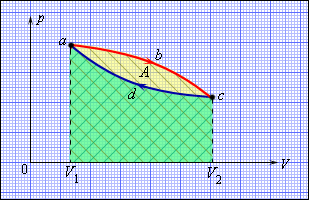
Рисунок 3.11.1. Круговой процесс на диаграмме (p, V). abc – кривая расширения, cda – кривая сжатия. Работа A в круговом процессе равна площади фигуры abcd.
Все круговые процессы обладают общей чертой. Они не могут привестись в действие при контакте рабочего тела только с одним тепловым. Их минимальное число должно быть равным двум.
Определение 2
Тепловой резервуар, обладающий более высоким значением температуры, носит название нагревателя, а с более низким – холодильника.
Рабочее тело при совершении кругового процесса получает от нагревателя некоторую теплоту Q1>0 и теряет, отдавая холодильнику, количество теплоты Q2<0. Для полного полученного рабочим телом за цикл количества теплоты Q справедливо следующее выражение:
Q=Q1+Q2=Q1-Q2.
Совершая цикл, рабочее тело приходит в свое первоначальное состояние, из чего можно сделать вывод, что изменение его внутренней энергии равняется ΔU=0. Основываясь на первом законе термодинамики, запишем:
∆U=Q-A=0.
Из этого следует:
A=Q=Q1-Q2.
Работа A, которую рабочее тело совершает за цикл, эквивалентна полученному за этот же цикл количеству теплоты Q.
Определение 3
Коэффициентом полезного действия или же КПД η теплового двигателя называют отношение работы A к полученному рабочим телом за цикл от нагревателя количеству теплоты Q1, то есть:
η=AQ1=Q1-Q2Q1.
Рисунок 3.11.2. Модель термодинамических циклов.
Коэффициент полезного действия теплового двигателя демонстрирует, какая доля тепловой энергии, которую получило рабочее тело от нагревателя, преобразовалась в полезную работу. Оставшаяся часть (1–η) была без пользы передана холодильнику. Коэффициент полезного действия тепловой машины не может быть больше единицы η<1. На рисунке 3.11.3 проиллюстрирована энергетическая схема тепловой машины.
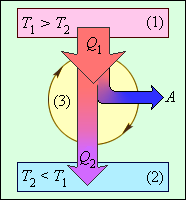
Рисунок 3.11.3. Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело, совершающее круговой процесс. Q1>0, A>0, Q2<0; T1>T2.
Виды тепловых двигателей
В технике свое применение находят двигатели, использующие круговые процессы. Рисунок 3.11.3 демонстрирует нам циклы, применяемые в бензиновом карбюраторном и в дизельном двигателях. Они оба в качестве рабочего тела используют смесь паров бензина или дизельного топлива с воздухом. Цикл карбюраторного двигателя внутреннего сгорания включает в себя две изохоры (1–2, 3–4) и две адиабаты (2–3, 4–1), дизельного двигателя -две адиабаты (1–2, 3–4), одну изобару (2–3) и одну изохору (4–1). Реальный КПД (коэффициент полезного действия) у карбюраторного двигателя составляет около 30 %, у дизельного двигателя – приблизительно 40 %.
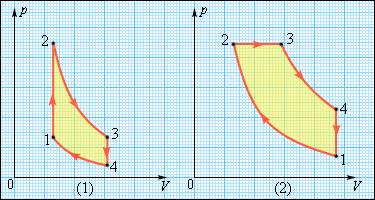
Рисунок 3.11.4. Циклы карбюраторного двигателя внутреннего сгорания (1) и дизельного двигателя (2).
Цикл Карно
Круговой процесс, изображенный на рисунке 3.11.5, состоящий из двух изотерм и двух адиабат был назван циклом Карно в честь открывшего его в 1824 году французского инженера. Данное явление впоследствии оказало колоссальное влияние на развитие учения о тепловых процессах.

Рисунок 3.11.5. Цикл Карно.
Находящийся в цилиндре, под поршнем, газ совершает цикл Карно. На участке изотермы (1–2) он приводится в тепловой контакт с нагревателем, обладающим некоторой температурой T1. Газ изотермически расширяется, при этом к нему подводится эквивалентное совершенной работе A12количество теплоты Q1=A12. После этого на участке адиабаты (2–3) газ помещается в адиабатическую оболочку и продолжает процесс расширения при отсутствующем теплообмене. На данной части цикла газ совершает работу A23>0. Его температура при адиабатическом расширении снижается до величины T2. На идущем следующим участке изотермы (3–4) газ приводится в тепловой контакт с холодильником в условиях температуры T2<T1. Производится процесс изотермического сжатия. Газом совершается некоторая работа A34<0 и отдается тепло Q2<0, эквивалентное произведенной им работе A34. Его внутренняя энергия не претерпевает изменений. На последнем оставшемся участке адиабатического сжатия газ снова помещают в адиабатическую оболочку. При сжатии его температура вырастает до величины T1, также совершается работа A41<0. совершаемая газом за цикл полная работа A эквивалентна сумме работ на отдельных участках:
A=A12+A23+A34+A41.
На диаграмме (p, V) данная работа равняется площади цикла.
Процессы на любом из участков цикла Карно квазистатичны. Например, оба участка 1–2 и 3–4, относящихся к изотермическим, производятся при пренебрежительно малой разности температур рабочего тела, то есть газа, и теплового резервуара, будь то нагреватель или холодильник.
Исходя из первого закона термодинамики, можно заявить, что работа газа в условиях адиабатического расширения или сжатия эквивалентна падению значения ΔU его внутренней энергии. Для 1 моля газа верно следующее выражение:
A=-∆U=-CV(T2-T1),
в котором T1 и T2 представляют собой начальную и конечную температуры рабочего тела.
Из этого следует, что работы, совершаемые газом на двух адиабатических участках цикла Карно, противоположны по знакам и одинаковы по модулю:
A23=-A41.
Коэффициент полезного действия η цикла Карно может рассчитываться с помощью следующих соотношений:
η=AQ1=A12+A34Q12=Q1-Q2Q1=1-Q2Q1.
С. Карно выразил коэффициент полезного действия цикла через величины температур холодильника T2и нагревателя T1:
η=T1-T2T1=1-T2T1.
Цикл Карно примечателен тем, что ни на одном из его участков тела, обладающие различными температурами, не соприкасаются. Любое состояние рабочего тела в цикле является квазиравновесным, что означает его бесконечную близость к состоянию теплового равновесия с окружающими объектами, то есть тепловыми резервуарами или же термостатами. В цикле Карно исключен теплообмен в условиях конечной разности температур рабочего тела и окружающей среды (термостатов), если тепло имеет возможность переходить без совершения работы. По этой причине любые другие возможные круговые процессы проигрывают ему в эффективности при заданных температурах нагревателя и холодильника:
ηКарно=ηmax
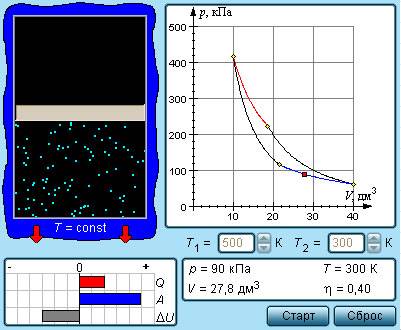
Рисунок 3.11.6. Модель цикла Карно.
Каждый участок цикла Карно и цикл в целом могут проходиться в обоих направлениях.
Определение 4
Обход цикла по часовой стрелке соответствует тепловому двигателю, в котором полученное рабочим телом тепло частично преобразуется в полезную работу. Обход против часовой стрелки соответствует холодильной машине, где некое количество теплоты отходит от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. Именно поэтому идеальное устройство, работающее по циклу Карно, носит название обратимой тепловой машины.
В реально существующих холодильных машинах применяются разные циклические процессы. Любой холодильный цикл на диаграмме (p, V) обходятся против часовой стрелки. На рисунке 3.11.7 проиллюстрирована энергетическая схема холодильной машины.
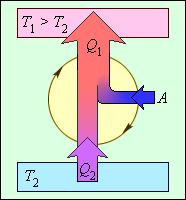
Рисунок 3.11.7. Энергетическая схема холодильной машины. Q1<0, A>0, Q2 > 0, T1>T2.
Работающее по холодильному циклу устройство может обладать двояким предназначением.
Определение 5
Если полезным эффектом является отбор некоторого количества тепла Q2 от охлаждаемых тел, к примеру, от продуктов в камере холодильника, то такое устройство является обычным холодильником.
Эффективность работы холодильника может быть охарактеризована следующим отношением:
βx=Q2A.
Таким образом, эффективность работы холодильника представляет собой количество тепла, отбираемого от охлаждаемых тел на 1 джоуль затраченной работы. В условиях подобного определения βх может быть, как больше, так и меньше единицы. Для обращенного цикла Карно справедливо выражение:
βx=T2T1-T2.
Определение 6
В случае, когда полезным эффектом является передача некоего количества тепла
|Q1| нагреваемым телам, чьим примером может выступать воздух в помещении, то такое устройство называется тепловым насосом.
Эффективность βТ теплового насоса может быть определена с помощью отношения:
βт=Q1A.
То есть она может определяться количеством теплоты, передаваемым более теплым телам на 1 джоуль затраченной работы. Из первого закона термодинамики следует:
Q1>A.
Следовательно, βТ всегда больше единицы. Для обращенного цикла Карно справедливо следующее выражение:
βт=1η=T1T1-T2.
Источник
(6.11)
и среднюю длину свободного пробега молекулы
, (6.12)
где – концентрация молекул газа, – эффективное сечение молекулы, – эффективный диаметр молекулы.
Кроме распределения Максвелла по скоростям молекул (6.5) необходимо упомянуть распределение Больцмана по высоте молекул в равновесном изотермическом столбе газа (например в изотермической модели атмосферы): , (6.13)
где и – концентрации молекул газа на высоте от поверхности Земли и на нулевой высоте соответственно, m – молярная масса газа, – ускорение свободного падения, которое считается постоянным в пределах всего столба газа, – абсолютная температура, постоянная по всему столбу газа.
Формула для давления газа
(6.14)
в сочетании с (6.13) позволяет определить давление газа на разных высотах в изотермической равновесной атмосфере или барометрическую формулу: (6.15)
Необходимо учесть тот факт, что давление атмосферы около поверхности Земли не зависит от температуры, так как масса всего воздуха в атмосфере, который своим весом давит на площадь Земли, не меняется ни зимой, ни летом.
6.1. Два моля азота сначала изобарически нагревают в два раза, а затем изотермически сжимают в два раза. Найти суммарное изменение энтропии в этих двух процессах. Ответ:
6.2. Теплоёмкость термодинамической системы (не идеального газа) в некотором процессе изменяется с температурой по закону C = b/T2 , где b = 800 кДж. К. Найти изменение энтропии системы в этом процессе при её нагревании от T 1 = 100 K до T 2 = 200 K.
Ответ:
6.3. Идеальный трёхатомный газ совершает циклический процесс, изображённый на диаграмме, где p 1 = 3p 2 , V 2 = 5V 1 . Найти к. п.д. этого процесса.
Ответ:
6.4. К. п.д. циклического процесса, изображённого на T – S – диаграмме, равен Найти температуру T1, если T3 = 300 К, а T 2 = 350 К.
Ответ: T1 = 400 K.
6.5. Идеальный газ находился в закрытом сосуде, а средняя квадратичная скорость молекул была равна . Потом газ был нагрет так, что средняя вероятная скорость молекул стала равна . =500 м/с; =450 м/с. Найти: отношение частоты ударов молекул о единичную площадку в первом и во втором состояниях .
Качественные задачи
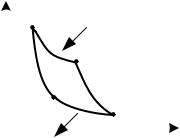
6.7к. На рисунке представлен прямой цикл тепловой машины в координатах , где термодинамическая температура, энтропия. Укажите участки, на которых тепло поступает в рабочее тело машины от нагревателей, и участки, где тепло отдается холодильнику:
а) 12, 23 – поступает; 41 – отдается б) 23 – поступает; 41 – отдается
в) 12, 23 – поступает; 34, 41 – отдается г) 12 – поступает; 34 – отдается
6.8к. Идеальная тепловая машина работает по циклу Карно (две изотермы 1-2 и 3-4 и две адиабаты 2-3 и 4-1). Как изменится энтропия рабочего тела в процессе изотермического расширения 1-2?
1) энтропия возрастет
2) энтропия уменьшится 3) энтропия не изменится
6.9к. На рисунке представлен график распределения молекул идеального газа по величинам скоростей (распределение Максвелла). С ростом температуры газа площадь под этим графиком будет:
а) оставаться неизменной б) расти пропорционально
в) расти пропорционально г) расти пропорционально
6.10к. На рисунке изображен цикл Карно в координатах (Т, S), где S – энтропия. Адиабатное расширение происходит на этапе…
а) 3 – 4 б) 4 – 1 в) 2 – 3 г) 1 – 2
6.11к. Если количество теплоты, отдаваемое рабочим телом холодильнику, увеличится в два раза, то коэффициент полезного действия тепловой машины…
а) уменьшится на ; б) увеличится на ;
в) увеличится на ; г) уменьшится на
6.12к. Зависимость концентрации молекул идеального газа во внешнем однородном поле силы тяжести от высоты для двух разных температур представлена на рисунке…
а) б) в) г)
6.12к. Зависимость давления идеального газа во внешнем однородном поле силы тяжести от высоты для двух разных температур представлена на рисунке…
а)б)в)г)
Задачи для самостоятельной работы.
6.1с. Два моля азота сначала изобарически нагревают в два раза, а затем изотермически сжимают в два раза. Найти суммарное изменение энтропии в этих двух процессах.
6.2с. Машина, работающая по циклу Карно, совершает за цикл работу в три раза меньшую, чем отдаваемое за цикл тепло. Найти температуру холодильника, если температура нагревателя t н0 = 99 0 С.
6.3с. Первая тепловая машина совершает циклический процесс 1–2–3–4–1, а вторая 4–3–5–6–4 (см. график). На сколько процентов больше коэффициент полезного действия второй тепловой машины. Принять T1 = 300 К; = 600 К.
S1 = 1 Дж/К; S2 = 2 Дж/К; S3 = 3 Дж/К.
6.4с. Идеальный газ находился в закрытом сосуде, а средняя квадратичная скорость молекул была равна =500 м/с. Потом газ был нагрет так, что средняя скорость молекул стала равна =470 м/с. Найти: отношение частоты ударов молекул о единичную площадку во втором и в первом состояниях .
6.5с. На берегу моря атмосферное давление составляет , а температура воздуха °С одинакова на разных высотах. Молярная масса воздуха m = 29 г/моль. Универсальная газовая постоянная , g = 10 м/с2. Если подняться на высоту Н =1 км над уровнем моря, то во сколько раз уменьшится давление p?
Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 |
Источник
90
7. Молярные теплоемкости идеального газа в про-
цессах 1→2 и 1→3 равны С1 и С2 соответственно. Их разность С2 – С1 имеет наиболь-
шую величину … .
а) для одноатомного газа б) для двухатомного газа в) для трехатомного газа
г) для любого идеального газа разность С2 – С1 оди-
накова
Ответ: г)
11.ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
11.1.Частные формулировки второго начала термодинамики
11.2.Энтропия и общая формулировка второго начала термодинамики
Второе начало термодинамики позволяет определить направление протекания процесса в изолированной системе.
11.1. Процесс перехода системы из состояния 1 в состояние 2 называют обратимым, если возвращение этой системы в исходное состояние через те же промежуточные состояния, что и в прямом процессе, но в обратной последовательности, можно осуществить без каких бы то ни было изменений в окружающих внешних телах. Всякий равновесный процесс является обратимым. Процесс перехода системы из состояния 1 в 2 называют необратимым, если обратный переход системы из 2 в 1 нельзя осуществить без изменений в окружающих телах. Все неравновесные (реальные) процессы необратимы. Рассмотрим примеры простейших необратимых процессов в изолированной систе-
91
ме. Это позволит получить частные формулировки второго начала термодинамики.
1. Рассмотрим теплоизолированный металлический стержень, исходная температура которого равна Т.
m , c, T
Предположим, что левая половина стержня самопроизвольно нагрелась до температуры T1 , а правая –
охладилась до температуры T2 . Опыт показывает, что хотя
первое начало термодинамики не запрещает этот процесс (необходимо лишь, чтобы выполнялось следующее соотношение между температурами Т1,Т2 и Т:
cmT c | m | T | c | m | T | и T T | 2T ), | |
2 | 1 | 2 | 2 | 1 | 2 | |||
он невозможен.
Первая частная формулировка второго начала тер-
модинамики: невозможны такие процессы, единствен-
ным конечным результатом которых был бы переход теплоты от тела менее нагретого к телу более нагре-
тому (постулат Клаузиуса).
2. Пусть мы имеем сосуд с газом. Допустим, что все молекулы газа собрались в одной из половин сосуда. Можно показать, что первому началу термодинамики этот
процесс не противоречит, но в природе такие процессы не наблюдаются.
Вторая частная формулировка второго начала тер-
модинамики: самопроизвольное «сжатие» газа в изолированной системе невозможно.
3. Третья частная формулировка второго начала термодинамики: невозможно построить такую перио-
92
дически действующую тепловую машину, которая, получив извне некоторое количество теплоты при любой температуре, полностью превращала бы ее в механическую работу и при этом возвращалась бы точно в ис-
ходное состояние (постулат Кельвина).
Устройство, которое периодически полностью превращало бы в работу получаемую извне теплоту, называют вечным двигателем II рода.
Частная формулировка второго начала термодинамики, предложенная Оствальдом: вечный двигатель II ро-
да невозможен.
Математическую формулировку второго начала можно получить, анализируя работу идеального теплового двигателя, совершающего в процессе работы обратимый цикл. Циклом или круговым процессом называют замкнутый процесс, в ходе которого система возвращается в исходное состояние.
Пусть рабочее тело тепловой машины т.е. тело, периодически изменяющее свои параметры, обычно – пар или газ, за каждый цикл получает количество теплоты Q1
от нагревателя, имеющего температуру T1 , и отдает коли-
чество теплоты Q2 хо- | |||
1 p1V1T1 Q1 | лодильнику, имеющему | ||
температуру | |||
a | 2p2V2T1 | T2 ( T2 T1 ). Обратимый | |
цикл, совершаемый теп- | |||
4 | б | ловой машиной в | этих |
p4V4T2 | 3p V T | условиях, может состоять | |
3 3 2 | как из процессов, в ходе | ||
Q2 | которых рабочее | тело | |
обменивается теплотой | |||
Рис. 20 | с нагревателем и холодильни- | ||
ком, так и из процессов, не сопровождающихся теплооб-
93
меном с внешней средой, т.е. адиабатических процессов. Процесс, сопровождающийся обменом теплотой, может быть обратимым только в том случае, если это равновес-
ный изотермический процесс, протекающий при темпе-
ратуре нагревателя или холодильника. Итак, обратимый цикл, совершаемый рабочим телом, вступающим в теплообмен с двумя телами бесконечно большой теплоемкости, может состоять из двух изотерм (при температурах нагревателя и холодильника) и двух адиабат. Этот идеальный обратимый цикл называют циклом Карно (рис. 20).
Для того чтобы сформулировать второе начало термодинамики в общем виде, необходимо ввести новую функцию состояния, которая называется энтропией.
11.2. Из анализа цикла Карно следует, что для обратимых процессов, примером которых являются равновес-
ные процессы, | Qобр | 0 , т.е. | Qобр | dS , |
Т | Т |
где S является функцией состояния, которую называют энтропией; Qобр – элементарное количество теплоты, пере-
данное системе в обратимом процессе.
Изменение энтропии вычисляют по формуле
Вычислим S для некоторых процессов.
1. Изменение состояния идеального газа
(p1V1T1→p2V2T2).
Так как Qобр dU A,будем иметь:
2 | dU A | 2 | m | dT | 2 | pdV | m | T | m | V | ||||
S | 2 | 2 | ||||||||||||
CV | CV ln | R ln | . | |||||||||||
T | M | T | T | M | T | M | V | |||||||
1 | 1 | 1 | 1 | 1 | ||||||||||
При обратимом адиабатическом процессе δQобр = 0
94
и S = const, поэтому такой процесс называют изоэнтропийным.
2. Изменение энтропии при нагревании или охлаждении твердых или жидких тел:
V 0 , A 0 , Q dU cmdT
2 Qобр | 2 | dT | T | ||
S | cm | 2 | . | ||
cm ln | |||||
T | T | T | |||
1 | 1 | 1 | |||
3. Изменение энтропии при изменении агрегатного состояния вещества
T const , Qобр dm ,
Как видно из рассмотренных примеров, энтропия неизолированной системы может, как увеличиваться, так и уменьшаться.
Однако энтропия изолированной системы ведет себя всегда однозначно: она не может уменьшаться, т.е. либо увеличивается, либо не изменяется. Это постулат, который называют вторым началом термодинамики:
Sизол. 0 . сист.
При этом энтропия отдельных частей системы может и увеличиваться и уменьшаться, но полная энтропия системы не убывает.
Максимально возможное значение энтропия изолированной системы достигает в состоянии теплового равновесия. Поскольку все естественные, самопроизвольные процессы необратимы, энтропия при этих процессах в изолированных системах всегда возрастает. Таким образом, второе начало термодинамики указывает направление протекания естественных процессов: естественные процессы в изолированных (или только адиабатно изолированных) си-
96
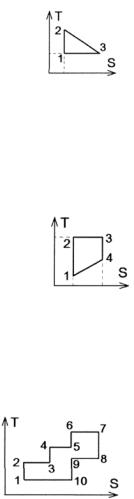
4. На рисунке представлен прямой цикл тепловой машины в координатах (T, S), где T – термодинамическая температура, S – энтропия.
Укажите участки, на которых тепло поступает в рабочее тело машины от нагревателей, и участки, где тепло отдается холодильнику.
а) 12, 23 – поступает; 31 – отдается; б) 12 – поступает; 23, 31 – отдается; в) 23 – поступает; 31 – отдается; г) 12 – поступает; 23 – отдается
Ответ: в) 5. На рисунке представлен прямой цикл тепловой
машины в координатах (T, S), где T – термодинамическая температура, S – энтропия. Укажите участки, на которых тепло поступает в рабочее тело машины от нагревателей, и участки, где тепло отдается холодильнику.
а) 23 – поступает; 41 – отдается б) 12 – поступает; 34, 41 – отдается в) 12, 23 – поступает; 34, 41 – отдается г) 12, 41 – поступает; 34 – отдается
Ответ: а) 6. На рисунке представлен прямой цикл тепловой
машины в координатах (T, S), где T –
термодинамическая температура, S – энтропия. Укажите участки, на которых тепло поступает в рабочее тело машины от нагревателей, и участки, где тепло отдается холодильнику.
а) 12, 34, 56 – поступает; 78, 910 – отдается; б) 23, 45, 67 – поступает; 89, 101 – отдается;
в) 12, 23, 34, 45, 56, 67 – поступает; 78, 89, 910, 101 – отдает-
ся;
97
г) 78, 89, 910, 101 – поступает; 12, 23, 34, 45, 56, 67 – отдается
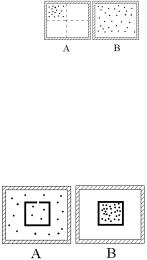
Ответ: б) 7. Один моль идеального газа находится в состоя-
нии А, когда все молекулы собрались в левой верхней четверти теплоизолированного сосуда. Как изменится энтропия этого
газа, когда газ перейдет в состояние В, когда все молекулы разлетятся по всему сосуду?
а) энтропия возрастет | б) энтропия уменьшится |
в) энтропия не изменится | г) нет правильного ответа |
Ответ: а) |
8. В большом теплоизолированном сосуде находится один моль идеального газа и маленький сосуд с отверстием (состояние А). Как изменится энтропия газа, если в результате маловероятного процесса все молекулы соберутся в маленьком сосуде
(состояние В)? | |
а) энтропия возрастет | б) энтропия уменьшится |
в) энтропия не изменится | г) нет правильного ответа |
Ответ: б) |
12.ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ
12.1.Средняя энергия молекулы. Внутренняя энергия идеального газа
12.2.Давление идеального газа с точки зрения молекулярно-кинетической теории
Системы с большим числом хаотически движущихся частиц подчиняются статистическим законам. Рассмотрим с этой точки зрения идеальный газ.
12.1. С помощью функции распределения газовых молекул по значениям скорости, которое будет рассмотре-
98
но ниже, можно вычислить среднее значение квадрата скорости молекул, а с его помощью и среднюю энергию поступательного движения газовых молекул:
K | mV 2 | m | V 2 | 3 | kT . | ||
2 | 2 | ||||||
2 | |||||||
Откуда следует, что:
1.Температура есть мера средней энергии хаотического движения;
2.Средняя энергия хаотического (теплового) движения молекул ~kT.
Заметим, что
V 2 V 2 | V 2 | V 2 | и V 2 | V 2 | V 2 |
x | y | z | x | y | z |
из-за хаотичности теплового движения, поэтому
mV 2 | mVy2 | mV 2 | 1 | ||
x | z | kT . | |||
2 | 2 | 2 | |||
2 | |||||
Полученный результат является частным случаем более общей теоремы о равномерном распределении энер-
гии по степеням свободы: на каждую степень свободы
молекулы приходится в среднем одинаковая кинетиче-
ская энергия теплового движения, равная 12 kT .
Согласно теореме о равномерном распределении энергии по степеням свободы полная энергия теплового движения молекулы:
E 2i kT .
Вычислим внутреннюю энергию идеального газа:
U | m | N A E | m | R | i | T , |
M | M | |||||
2 | ||||||
где NA – число Авогадро (число молекул в моле газа),

99
С | dU | i | R . | ||||||||||||
V | dT | 2 | |||||||||||||
Из приведённого выражения видно, | что теплоем- | ||||||||||||||
СV | кость | не должна | зависеть от | ||||||||||||
7 | 2 R | температуры. Однако опыт по- | |||||||||||||
5 | 2 R | казывает, что это не так. При- | |||||||||||||
мерная зависимость СV двух- | |||||||||||||||
3 2 R | H2 | атомного газа от | температуры | ||||||||||||
представлена на рисунке 21. | |||||||||||||||
Рис. 21 | T | Из графика следует, что | |||||||||||||
не все степени свободы прояв- | |||||||||||||||
ляются одновременно. При низких температурах исчезают (вымораживаются) вращательные степени свободы, при высоких температурах появляется колебательная степень свободы.
Этот экспериментальный результат может быть объяснен только с позиций квантовой теории.
12.2. Молекулярно-кинетическая | теория позволяет | ||||
получить уравнение | состояния | ||||
идеального газа. Полагаем, | что | ||||
p | |||||
молекулы идеального | газа при | ||||
ударах друг с другом и со стен- | |||||
m V | ками сосуда | ведут | себя | как | |
упругие шары (рис. 22). При | |||||
x | |||||
ударе молекулы идеального газа | |||||
о стенку, она передает стенке | |||||
импульс p 2mV cos 2mVx | |||||
Рис. 22 Задачу расчета давления можно упростить, предпо-
ложив, что молекулы движутся только вдоль координатных осей. Будем считать, что в направлении каждой из осей в среднем движется 1/6 часть всех молекул (с учетом
Источник