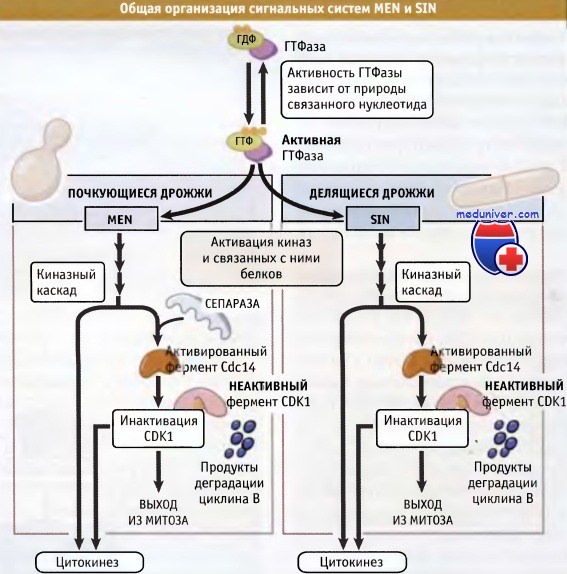
Точки контроля клеточного цикла
Участники контроля клеточного цикла
Клеточный цикл контролируется путем взаимодействия трех типов
белков: циклинзависимые киназы (Cdk), циклины
– белки, взаимодействующие с Cdk c образованием комплексов
и ингибиторы комплексов Cdk-циклин.
Циклинзависимые киназы (Cdk) – ферменты фосфорилирующие другие
белки, изменяют их функцию. Клеточный цикл контролируется изменением
активности Cdk, которая регулируется периодическим образованием
и распадом их регуляторных субъединиц – циклинов. Смена синтезов
и разрушений различных циклинов обеспечивает переходы и протекания
различных фаз клеточного цикла. При этом концентрация Cdk
постоянна в течении всего клеточного цикла. В разные фазы
клеточного цикла образуются разные циклины, которые связываясь
с Cdk образуют различные Cdk-циклиновые комплексы. Эти комплексы
регулируют разные фазы клеточного цикла и поэтому называются
G1-, G1/S- , S- и М-Cdk (рис.1).
рис.1 Концентрации различных комплексов Cdk-циклин
в клеточном цикле.
Контрольные точки клеточного цикла
1. Точка выхода из G1-фазы, называемая
Старт – у млекопитающих и точкой рестрикции
у дрожжей. После перехода через точку рестрикции R в конце
G1 наступление S становится необратимым, т.е. запускаются
процессы ведущие к следующему делению клетки.
2.
Точка S – проверка точности репликации.
3.
Точка G2/M-перехода – проверка завершения репликации.
4. Переход от метафазы к анафазе митоза.
Контроль различных этапов клеточного
цикла
ARC подавляет S- и M-циклины и не подавляет G1/S-циклины.
В G1-фазе работают различные ингибиторы Cdk.
Внутренние и внешнии сигналы приводят к образованию G1/S-
и S-циклинов и активации G1/S–Cdks.
Активность G1/S–Cdk увеличивается потому что G1/S циклины
не атакуются APC и потому что G1
Cdk ингибиторы так же не действуют на G1/S–Cdks
(у мух и дрожжей) или удаляются от G1/S–Cdks другими
механизмами (у млекопитающих).
S-Cdk инактивирует ингибиторы Cdk и подавляет ARC, которые
в G1-фазе подавляли S-Cdk. S-Cdk фосфорилируют
различные белки, что ведет к началу дупликации ДНК и S-фазы.
После начала S-фазы S/G1-Cdk обеспечивают собственную
инактивацию.
В конце S-фазы, в G2-фазе начинают накапливаться
М-Cdk, приводящая к вступлению клетки в митоз. М-Cdk активирует
ARC-комплекс, управляющий метафазно-анафазным переходом. Основная
функция ARC-комплекса состоит в разрушении когезинов, приводящее
к началу расхождения хромосом
Циклин зависимые киназы Cdk1-5 в клетках млекопитающих
Cdks активируется при связывании с циклинами (так же как фосфориляция
и дефосфориляция киназ). Cdks-фосфорилируют белки участвующие
в кл цикле
M-phase Cdk (M-Cdk) запускают каскад белковых фосфориляций,
запускающих М-фазу к.ц. (конденсация хромосом, разрушение
ядра, перестройка АГ иЭР, потеря адгезии с большинством других
клеток и внеклеточному матриксу, реорганизация цитоскелета)
anaphase-promoting complex (APC) регулятор митоза – инициация
разделения и расхождения хромосом и инактивация М-Cdk в конце
митоза
При выходе из G0 под действием факторов роста начинает
синтезироваться Cdk2-циклинD: распознает в-ва, регулирующие
ферменты синтеза белков, необходимых для репликации ДНК. В
это же время выявляются Cdk4-циклинD, и Cdk5циклинD
циклин-cdks
запускает М-стадию кц, деградация циклина снижает активность
cdks
Cdk2-циклинE появляется в G1 и достигает max
на границе G1-S, после чего его концентрация
резко снижается
Cdk2-циклинА появляется в промежутке G1-S и присутствует
в высокой концентрации на протяжении S
Сdk2-циклинB в конце G2 до М – резко разрушается
в каждой стадии синтезируются свои циклины M-циклины запускают
события митоза, G1/S-циклины – связывают цзк
в конце G1 подготавливает кл к S-фазе, S-циклины
– связывают цзк, запуская репликацию, G1-циклины
обеспечивают прохождение через точку рестрикции.
Регуляция репликации
Перед началом репликации Sc ORC-комплекс (origin recognition
complex) садится на ori – точку начала репликации. Cdc6 представлен
во всем клеточном цикле, но его концентрация возрастает вначале
G1, где он связывается c ОRC комплексом, к которому затем
присоединяются Mcm белки с образованием pre-replicative complex
(pre-RC). После сборки pre-RC клетка готова к репликации.
Для инициации репликации S-Cdk соединяется с протеинкиназой
(?), которая фосфорилирует pre-RC. При этом Cdc6 диссоциирует
от ОRC после начала репликации и фосфорилируется, после чего
убиквитинируется SCF и деградирует. Изменения в pre-RC препятствуют
повторному запуску репликации. S-Cdk так же фосфорилирует
некоторые Mcm белковые комплексы, что запускает их экспорт
из ядра. Последующая дефосфориляция белков вновь запустит
процесс образования pre-RC.
Регуляция митоза
В эмбриональных клетках синтез М-циклина постоянен во всем
клеточном цикле и накопление его происходит из-за уменьшения
деградации. У большинства клеток М-циклин синтезируется во
время G2 и М-фаз. Накопление циклина ведет к накоплению M-Cdk.
Cdk ингибируется, фосфорилируясь протеинкиназой Wee1. Активация
Cdc25 в поздней G2 дефосфорилирует M-Cdk, так же происходит
репрессия Wee1. Две протеинкиназы фосфорилируют Cdc25 – Polo
kinase и M-Cdk. M-Cdk так же фосфорилирует и ингибирует Wee1.
Способность M-Cdk активировать свой собственный активатор
(Cdc25) и ингибировать свой собственный ингибитор (Wee1) предполагает,
что активация M-Cdk в митозе резко усиливается при наличии
такой позитивной обратной связи. Малое количество активированных
Cdc25 активируют M-Cdk, которые активирует еще больше Cdc25
и супрессируют Wee1. Это приводит к большей дефосфориляции
M-Cdk и активации и тд. Такой механизм обеспечивает полную
активацию всех M-Cdk
Фосфорилирование ламинов M-Cdk приводит к их деградации. М-Cdk
фосфорилирует несколько субъединиц конденсинов, запуская конденсацию
хромосом.
M-Cdk фосфорилирует различные белки, запуская реорганизацию
микротрубочек и другие события ведущие к организации веретена
деления.
Циклин-зависимые
киназы
| вид | название | синоним | размер | функция |
| S.cerevisiae | Cdk1 | Cdc28 | 298 | все стадии клеточного цикла |
| S.pombe | Cdk1 | Cdc2 | 297 | все стадии клеточного цикла |
| D.melanogaster | Cdk1 Cdk2 Cdk4 | Cdc2 Cdc2c Cdk4/6 | 297 314 317 | M G1/S, S, возможно М G1 обеспечивает рост |
| X.laevis | Cdk1 Cdk2 | Cdc2 | 301 297 | M S, возможно S |
| H.sapiens | Cdk1 Cdk2 Cdk4 Cdk6 | Cdc2 | 297 298 303 326 | M G1/S, S, возможно М G1 G1 |
В животных клетках имеются, по крайней мере, 7 различных
Cdk. Cdk1,2,4,6 напрямую участвуют в регуляции клеточного
цикла, тогда как остальные фосфорилируют другие Cdk и называются
Cdk-активирующие киназы (CAK).
Cdk7,8,9 являются регуляторами РНК полимеразы II. Cdk5 участвует
в дифференцировке нервных клеток.
У дрожжей Sc и Sp все события клеточного цикла контролируются
одной Cdk1. У многоклеточных организмов события контролируются
Cdk1 и Cdk2. Также у высших эукариот имеются Cdk4 и Cdk6
которые регулируют клеточный цикл в ответ на внеклеточные
сигналы.
Cdk фосфорилируют сотни различных белков по сериновым (S)
или треониновым (T) аминокислотным остаткам. Cdk узнает
мотиф другого белка по которому необходимо фосфорилировать:
[S/T*]PX[K/R], где S/T*- место фосфорилирования, X – любая
аминокислота, K/R-основные аминокислоты лизин (K) или аргинин
(R).
В отсутствии циклина активный центр Cdk заблокирован.
Cdk состоит из нескольких доменов: Т-петля (инактивирующая
петля) – закрывает активный центр в отсутствии циклина.
L12 helix, PSTAIRE helix.
Циклины
| Вид | G1 | G1/S | S | M |
| S.cerevisiae | Cln3 (Cdk1) | Cln1,2 (Cdk1) | Clb5,6 (Cdk1) | Clb1,2,3,4 (Cdk1) |
| S.pombe | Puc1? (Cdk1) | Puc1 Cig1?, (Cdk1) | Cig2, Cig1? (Cdk1) | Cdc13 (Cdk1) |
| D.melanogaster | cyclin D (Cdk4) | cyclin E (Cdk2) | cyclin E, A (Cdk2,1) | cyclin A, B, B3 (Cdk1) |
| X.laevis | cyclin E (Cdk2) | cyclin E, A (Cdk2,1) | cyclin A, B (Cdk1) | |
| H.sapiens | cyclin D1,2,3 (Cdk4,6) | cyclin E (Cdk2) | cyclin A (Cdk2,1) | cyclin B (Cdk1) |
Циклины – цитоплазматические белки. Разрушение циклинов
происходит в протеосомах (см. обзор Протеасомы). Циклин
B – белок киназный домен, регуляторная субъединица. Начинает
синтезироваться в G1, достигает max в S и ранней профазе
и быстро разрушается в начале анафазы М. Когда концентрация
регуляторной субъединицы возрастает – активируется киназный
домен. Фосфорилирование специфических белков приводит к
компактизации х-м, разрушению ядерной об-ки и сборке веретена.
Циклин разрушается в протеасомах. Сигнальная послед-ть из
8-10 а-кт –блок разрушения – узнается распознающим белком,
убиквитинлигаза присоединиет убиквитин (76а-кт) к остаткам
лизина, который полиUb и узнается РНК-белковым комплексом
протеасомой. Фосфатаза переводит распознающий белок в неактивное
состояние, а циклин фосфорилирует переводя в активное ?чем
больше циклина, тем быстрее он разрушается.
Циклин фосфорилирует сериновые и треониновые остатки ламинов
вызывая их деполимеризацию, фосфорилирует гистон H1, участвует
в фосфорилировании блокирующим везикулярный транспорт –
разрушение ЭПР и АГ, фосфорилирует участок легкой цепи миозина,
ингибируя АТФ-азную активность и связывание с F-актином
– блокировка цитокинеза в раннем митозе. После разрушения
циклина белки дефосфорилируются.
Циклины – активаторы Cdk. Циклины, так же как и Cdk вовлечены
в различные, помимо контроля клеточного цикла, процессы.
Циклины разделяются на 4 класса в зависимости от времени
действия в клеточном цикле: G1/S, S, M и G1 циклины.
G1/S циклины (Cln1 и Cln2 у S. cerevisiae, циклин E у позвоночных)
достигает максимальной концентрации в поздней G1-фазе и
падает в S-фазе.
G1/S cyclin–Cdk комплекс запускает начало репликации ДНК
выключая различные системы подавляющие S-phase Cdk в G1-фазе
G1/S циклины также инициируют дупликацию центросом у позвоночных,
образование веретенного тела у дрожжей. Падение уровня G1/S
сопровождается увеличением концентрации S циклинов (Clb5,
Clb6 у Sc и циклин A у позвоночных), который образует S
циклин-Cdk комплекс который напрямую стимулирует ДНК репликацию.
Уровень S циклина остается высоким в течении всей S, G2-фаз
и начала митоза, где помогает началу митозу в некоторых
клетках.
М-циклины (Clb1,2,3 и 4 у Sc, циклин B у позвоночных) появляется
последним. Его концентрация увеличивается, когда клетка
переходит к митозу и достигает максимума в метафазе. М-циклин-Cdk-комплекс
включает сборку веретена деления и выравнивание сестринских
хроматид. Его разрушение в анафазе приводит к выходу из
митоза и цитокиезу.
G1 циклины (Cln3 у Sc и циклин D у позвоночных) помогает
координировать клеточный рост с входом в новый клеточный
цикл. Они необычны, так как их концентрация не меняется
от фазы клеточного цикла, а меняется в ответ на внешние
регуляторные сигналы роста.
APC комплекс (Anaphase-Promoting Complex)
Убиквитин лигаза митоза – APC состоит из 12 субъединиц и регулирует
различные процессы митоза, такие как разделение сестринских
хроматид (запускает разрушение когезинов), переход к анафазе,
анафазное расхождение хромосом, выход из митоза, разрешение
S-фазы. ARC разрушает митотический циклин B.
Имеются различные белки регулирующие активность ARC комплекса,
такие как Mps1, Bub1, Bub3, BubR1, Mad1 и Mad2. Они ингибируют
ARC комплекс, что ведет к остановке клеточного цикла в метафазе
митоза.
Ингибиторы комплексов циклин-Cdk
| Вид | Название | Синонимы | Гомологи | Цели, функции |
| S. cerevisiae | Sic1 Far1 | Rum1 нет | ингибирует S- и M-Cdk, подавляет активность Cdk в G1 ингибирует G1/S–Cdk в ответ на феромоны | |
| S. pombe | Rum1 | Sic1 | ингибирует S– и М–Cdks, подавляет активность Cdk в G1 | |
| D. melanogaster | Roughex/Rux Dacapo/Dap | нет Cip/Kip | ингибирует S– и M–Cdk, подавляет активность Cdk in G1 ингибирует G1/S–Cdks, подавляет активность Cdk в G1 | |
| X. laevis | Xic1 | Kix1 | Cip/Kip | ингибирует G1/S– и S–Cdk |
| H. sapiens | p21 p27 p57 p15INK4b p16INK4a p18INK4c p19INK4d | Cip1/Waf1 Kip1 Kip2 – – – – | Cip/Kip Cip/Kip i Cip/Kip INK4 INK4 INK4 INK4 | ингибирует G1/S– и S–Cdk, активирует cyclin D–Cdk4 ингибирует G1/S– и S–Cdks, активирует cyclin D–Cdk4 ингибирует G1/S– и S–Cdks, активирует cyclin D–Cdk4 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 |
Помимо циклинов имеются и другие регуляторы, такие как
p27, p53, анафазный ингибитор, Cdc20, polo-like киназа,
aurora киназа, Nek2 киназа и кинезинзависимые моторные белки.
p53 (опухолевый супрессор) – нестабильный
белок, узнает поврежденную ДНК, стабилизируется, накапливается
и стимулирует синтез ингибитора Cdk2. Нарушения в работе
p53 приводят к развитию раковых заболеваний.
p21 семейство – белки содержащие гомологичные
N-концевые участки, взаимодействующие с Cdk-циклинами. Активируются
в стареющих клетках. Образование индуцируется опухолевым
супрессором p53. Может блокировать субъединицы ДНК-полимеразы
p27 – межклеточные контакты стимулируют
его синтез – контактное подавление клеточного роста – задержка
в G0. Когда фибробласты помещаются в чашку они
начинают делиться пока монослой не покроет чашку – контактное
торможение. В опытах показано что существенную роль играют
не контакты, а степень распластывания – чем меньше распластана
клетка, тем больше времени занимает клеточный цикл. Округление
клеток сопровождается снижением общей интенсивности белкового
синтеза.
p57
p15, p16 семейство: взаимодействуют
с Cdk4 и Cdk6. Нарушают связь с циклинами D. Вероятно, задерживают
рост клеток.
Сокращения:
cdc-гены (cell-division-cycle genes) – гены клеточного цикла.
Источник
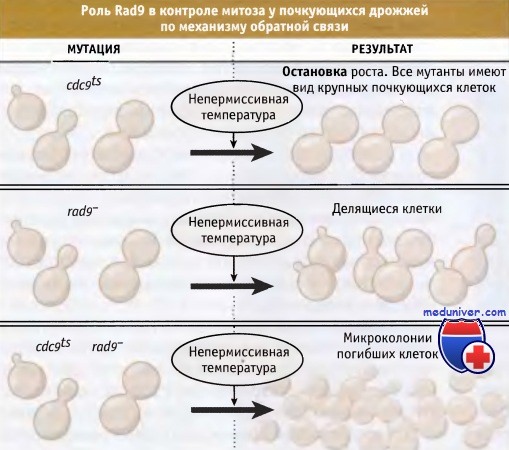
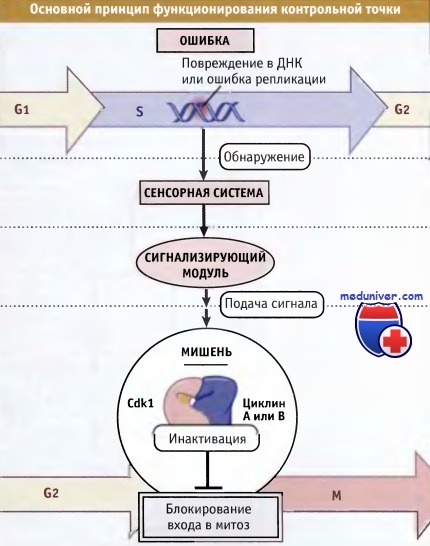
Координация событий клеточного цикла• Наступление процессов клеточного цикла носит скоординированный характер • Координация событий клеточного цикла достигается за счет специфических биохимических процессов, которые происходят в точках проверки. Точки контроля задерживают дальнейшее продвижение клетки по циклу, если не завершилось предыдущее событие • Точки контроля необходимы, только когда клетки находятся в условиях стресса или повреждены. Однако они также могут функционировать в нормальном цикле для обеспечения координации событий При каждом цикле митотического деления клетка удваивает и сегрегирует свою ДНК, а затем делится. Каким образом поддерживается такой порядок процессов клеточного цикла? Происходят ли нарушения этого порядка и каковы их последствия? Как отмечалось выше, для обеспечения определенного порядка протекания процессов цикла, в клетке действует специальная система наблюдения или точек контроля. Она функционирует при изменении активности основных регуляторных факторов клеточного цикла, таких как СЕЖ и АРС. Простые и изящные эксперименты Рао и Джонсона по слиянию клеток позволили выявить не только основные регуляторы прохождения клетки по циклу, описанные ранее, но также показали существование точек проверки. Было обнаружено, что при слиянии С2-клеток с S-фазными клетками ядра 02-клеток «ждут» S-фазных ядер для того, чтобы закончить репликацию ДНК до начала разрушения ядерной оболочки и вступления в митоз. Это позволило всыказать предположение о существовании механизма, предотвращающего наступление митоза до момента полного завершения репликации ДНК. Представление о существовании точек контроля, регулирующих порядок наступления событий клеточного цикла и задерживающих прохождение клетки по циклу при возникновении ошибок, полностью сформировалось при характеристике мутантов почкующихся дрожжей, rad9. При отборе чувствительных к облучению клеток дрожжей было выделено несколько мутантов, которые получили название rad мутантов. Ионизирующая радиация повреждает ДНК. Ожидалось, что скрининг радиочувствительных клеток поможет обнаружить мутанты, дефектные по системе репарации ДНК. Однако были также идентифицированы мутанты, дефектные по другим генам. При тщательном микроскопическом исследовании rad мутантов среди клеток остановившихся в цикле, были выявлены различия фентипа. После повреждения ДНК большинство rad мутантов никогда не делились. Наоборот, мутанты rad9 до момента гибели делились несколько раз, образуя микроколонии. Такое поведение большинства rad мутантов позволило предположить, что повреждение ДНК вызывает задержку прохождения клетки по циклу, что дает время, необходимое для репарации повреждений. Однако, поскольку большинство rad мутантов обладает дефектной системой репарации, повреждения ДНК не репарируют ся, и поэтому такие мутанты необратимо останавливаются в цикле. Продолжение пролиферации мутантов rad9 в этих условиях позволяет предполагать, что у них повреждение не узнается машиной клеточного цикла. Таким образом, было высказано предположение о существовании Rad9-зависимой точки контроля, которая следит за целостностью ДНК; эта точка контроля узнает дефекты в ДНК и сигнализирует о них остановкой клеточного цикла. Для клеток дикого типа точка контроля не требуется, и она необходима, только когда нарушается целостность структуры ДНК. Многие cdc мутанты по сигналу Rad19-зависимой точки контроля также останавливаются в цикле. Например, cdc9 мутанты, дефектные по ДНК-лигазе, необходимой для завершения репликации ДНК, останавливаются в цикле, образуя крупные почкующиеся клетки. Однако двойные мутанты cdc9rad9 не задерживаются в цикле, продолжают делиться и погибают. Таким образом, rad9 также участвует в остановке клеток в цикле, если не завершилась репликация ДНК. Сигнальный процесс, который вызывает остановку клетки в цикле при незавершении репликации, носит название точки контроля за репликацией. Рисунок ниже иллюстририрует роль rad9 в функционировании точки контроля. Все точки контроля клеточного цикла содержат три компонента: Основной принцип функционирования точки контроля, узнающей дефекты в ДНК или незавершенность ее репликации, схематически представлен на рисунке ниже.
– Также рекомендуем “Точки контроля репликации и повреждения ДНК” Оглавление темы “Контроль клеточного цикла”:
|
Источник