Гены тромбофилии и фолатного цикла что это
27 декабря 2017 г.
Как только у женщины появляются мысли стать мамой, то она обращается в женскую консультацию для полного обследования. И в первую очередь врач назначает фолиевую кислоту. Насколько важна роль этого витамина для организма, что такое фолатный цикл и в чем заключается опасность при полиморфизме генов?
Полиморфизмы генов фолатного цикла: что это такое?
Для начала разберемся, что такое полиморфизм генов. Гены у разных людей похожи, но имеют небольшие нюансы, которые и отличают нас друг от друга. Эти нюансы, различия и называются полиморфизмами.
Причиной полиморфизма генов являются изменения отдельных участков в молекуле ДНК, что приводит к изменению свойств гена (иногда в лучшую, а иногда – в худшую сторону). Некоторые изменения ведут к генетическим заболеваниям, другие не влекут за собой болезни, но являются фактором предрасположенности к ряду патологий.
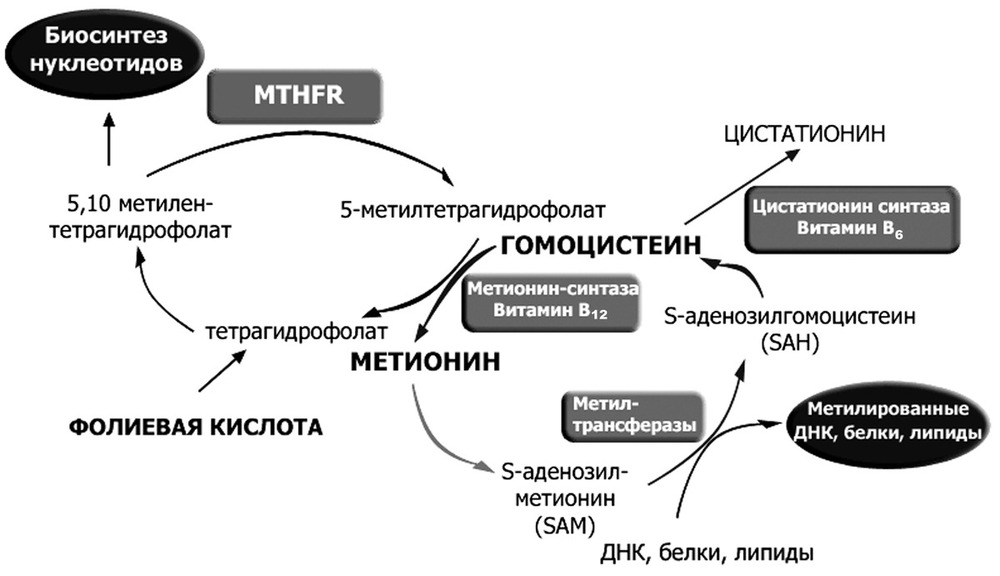
А что же такое фолатный цикл? Фолатный цикл – это совокупность процессов, в результате которых при помощи ферментов и коферментов из гомоцистеина появляется незаменимая аминокислота метионин.
Ферменты – это вещества, ускоряющие биохимические процессы в организме. В фолатном цикле принимают участие 3 фермента:
- метилентетрагидрофолатредуктаза MTHFR (для перевода фолиевой кислоты в активную форму);
- метионин-синтаза-редуктаза MTRR (влияет на активность метионин-синтазы);
- метионин-синтаза MTR (осуществляет превращение гомоцистеина);
Коферменты – это производные витаминов, необходимые для функционирования ферментов.
Коферментами являются фолаты, а для обмена фолатов необходимы витамины:
- В9 (фолиевая кислота);
- В6 (пиридоксин);
- В12 (цианокобаламин).
Фолатный цикл обеспечивает нормальное функционирование органов и систем. При мутации в генах происходит замена одного нуклеотида на другой, изменения числа повторяющихся фрагментов ДНК. Это все ведет к изменению биохимических свойств фермента и его функции, в результате чего нарушается превращение гомоцистеина в метионин.
Сбой в фолатном цикле влечет за собой увеличение концентрации в крови гомоцистеина, оказывающего на организм токсическое, атерогенное и тромбофиличское действие. Иными словами, возрастает риск некоторых осложнений беременности (например, гестоза или отслоения плаценты) и возникновения дефектов у плода.

Из-за чего может нарушиться метаболизм гомоцистеина и произойти сбой в фолатном цикле?
- генетические дефекты ферментов;
- дефицит витаминов вследствие недостаточного поступления с пищей или на фоне приема лекарственных средств (эстрогенсодержащих оральных контрацептивов, цитостатиков, противоэпилептических средств).
Кроме того, повышенный уровень гомоцистеина может быть при хронических заболеваниях: почечной недостаточности, анемии, псориазе, гипотиреозе; злокачественных опухолях яичников, молочной и поджелудочной желез.
Информация о ферментах фолатного цикла (MTHFR, MTRR, MTR) содержится в генах, которые именуются генами фолатного цикла. Эти гены могут иметь свои особенности у каждого человека – полиморфизмы. Исследование полиморфизмов в таких генах способно выявить, есть ли в конкретном случае риск нарушения фолатного цикла.
Важно! Не все полиморфизмы в генах фолатного цикла могут приводить к повышению гомоцистеина.
Диагностика полиморфизмов генов фолатного цикла
Исследование на полиморфизм генов фолатного цикла проводят методом полимеразной цепной реакции. Кровь для анализа лучше сдавать утром натощак, последний прием пищи должен быть накануне вечером.
Расшифровку данных полиморфизма генов фолатного цикла (MTR, MTRR, MTHFR) проводит только врач. Даже при выявленном полиморфизме не надо отчаиваться – это говорит только о предрасположенности к заболеванию и не означает, что в течение беременности обязательно будут осложнения.
Полиморфизмы генов фолатного цикла: в чем риск для матери и плода?
Уровень гомоцистеина при нормально протекающей беременности чуть понижается, составляя 4,6-12,4 мкмоль/л, и восстанавливается только после родов. Но при нарушениях в фолатном цикле он повышается и может оказывать токсическое, тромбофилическое и атерогенное действие.
Все это приводит к развитию различных патологических процессов со стороны матери и плода:
- угроза прерывания беременности;
- неудачное ЭКО;
- неразвивающаяся беременность;
- фетоплацентарная недостаточность;
- хроническая внутриутробная гипоксия плода;
- поздний гестоз;
- внутриутробная задержка роста и развития плода;
- пороки развития плода (дефекты нервной трубки, деформация лицевого скелета с незаращением неба и верхней губы, анэнцефалия);
- повышается риск развития синдрома Дауна.
Планирование беременности при полиморфизмах генов фолатного цикла
При планировании беременности важно выявить возможные хромосомные аномалии, в том числе носительство полиморфизма генов гемостаза и фолатного цикла.
Чтобы исключить наличие какой-либо патологии, обязательно надо посетить акушера-гинеколога. При опросе врач досконально соберет анамнез и при необходимости назначит дополнительное обследование, консультацию генетика.
Уровень гомоцистеина проверяют, если:
- предыдущие беременности завершились неблагоприятным исходом;
- у женщины повышенная свертываемость крови;
- у родственников будущей мамы были тромбозы, инфаркты или инсульты до 50 лет.
Важно! В течение 2-3 месяцев до зачатия всем женщинам совместно с партнером рекомендуют пропить фолиевую кислоту в профилактической дозе 0,4 мг/сутки.
Ведение беременности при полиморфизмах генов фолатного цикла
При наступлении беременности фолиевую кислоту продолжают пить до 12 недель включительно, что обеспечивает снижение риска нарушений со стороны нервной системы плода. Витамин выпускается в таблетках по 1 мг, назначают по 1 таб/сутки.
При полиморфизме дозировка может увеличиваться до 5 мг/сутки, а прием продолжают в течение всей беременности совместно с витаминами группы В. В критические сроки проводят дополнительную терапию.
Врач-генетик может порекомендовать принимать не обычный В9, а фолиевую кислоту в активной форме. В чем разница? Дело в том, что в чистом виде фолиевая кислота организмом не усваивается – для этого она должна преобразоваться в определенную форму – метилфолат. При мутации некоторых генов процесс превращения В9 в усвояемую форму нарушен, поэтому обычная фолиевая кислота усваивается плохо. В этом случае препаратом выбора становится ее активная форма – L-метилфолат, который легко всасывается в кровь без каких-либо преобразований.
Рекомендуют употреблять больше пищи с витамином В9 – шпинат, брокколи, горошек, авокадо, банан, арахис, бобовые, белый рис, хлеб из муки грубого помола, печень, мёд, томатный и апельсиновый соки.
В обязательном порядке контролируют уровень гомоцистеина в динамике, коагулограмму.
Врач-гинеколог о гомоцистеине при планировании беременности.
Роды при полиморфизмах генов фолатного цикла
В большинстве случаев на фоне профилактических мероприятий и проводимой терапии роды проходят хорошо.
Но могут быть следующие осложнения:
- преждевременные роды;
- преэклампсия, когда показано оперативное вмешательство в экстренном порядке;
- преждевременная отслойка нормально расположенной плаценты;
- кровотечение.
Главное, не переживайте и соблюдайте все рекомендации.
В послеродовом периоде до окончания кормления грудью продолжайте прием фолиевой кислоты по 0,4-1 мг/сутки.
Владлена Размерица, акушер-гинеколог, специально для Mirmam.pro

Фолиевая кислота в продуктах
Фолацин и фолиевая кислота: делаем правильный выбор

Путешествия во время беременности: польза или вред?

Как похудеть во время беременности, не навредив ребенку?
Источник
Комплексное генетическое исследование риска развития тромбофилии и нарушения фолатного цикла.
Наличие генетической предрасположенности к тромбофилии сопряжено с повышенным риском развития осложнений беременности: привычное невынашивание, плацентарная недостаточность, задержка роста плода, поздний токсикоз. Полиморфизмы генов F2, F5, F7, F13, FGB, PAI-1, ITGA2, ITGB3 и MTHFR, MTRR, MTR также могут являться причиной развития венозных тромбозов.
Тромбофилия
Тромбофилия — патологическое изменение в свёртывающей системе крови, приводящие к образованию кровяных сгустков.
Тромбофилия может быть наследственной и приобретённой. Приобретённые тромбофилии могут возникнуть во время беременности или при ожирении. Появление тромбофилий может быть обусловлено внешними причинами: хирургическими операциями, использованием гормональных контрацептивов, антифосфолипидным синдромом, повышением уровня гомоцистеина, курением или долгим периодом неподвижности. При наследственных тромбофилиях происходят изменения в генах, ответственных за поддержание гемостаза.
Наиболее частыми из известных генетических факторов, предрасполагающих к тромбозам, являются полиморфизмы в генах факторов свёртывания крови F2 (c.*97G>A) и F5 (c. 1601G>A), и полиморфизмы в генах фолатного цикла (метилентетрагидрофолат-редуктаза, MTHFR; метионин-синтаза редуктаза, MTRR; метионин-синтаза, MTR). Полиморфизмы в генах факторов F2 и F5 вносят больший вклад в риск развития тромбофилий и имеют самостоятельное клиническое значение. Одновременное выявление нескольких генетических факторов предрасположенности к тромбофилическим состояниям значительно увеличивает риск развития тромбозов.
Тромбозы — наиболее частое проявление тромбофилии
При тромбозах в сосудах образуются тромбы, которые блокируют кровоток. Она может приводить к развитию артериальных и венозных тромбозов, которые в свою очередь зачастую являются причиной инфаркта миокарда, ишемической болезни сердца, инсульта, тромбоэмболии лёгочной артерии и др. Повышенная склонность к тромбообразованию — наиболее частое проявление тромбофилии.
Ген F2
Ген F2 кодирует аминокислотную последовательность белка протромбина. Протромбин или коагуляционный фактор II является одним из главных компонентов свёртывающей системы крови. В результате его ферментативного расщепления образуется тромбин. Данная реакция является первой стадией образования кровяного сгустка.
Полиморфизм гена F2 (20210 G-> A) обусловлен заменой нуклеотидного основания гуанина (G) на аденин (A) в позиции 20210 гена, приводит в случае варианта А к повышенной экспрессии гена. Избыточная продукция протромбина является фактором риска инфаркта миокарда, различных тромбозов, в том числе тромбоэмболии лёгочной артерии, часто имеющей смертельный исход. Неблагоприятный вариант полиморфизма (А) наследуется по аутосомно-доминантному типу. Это означает, что повышенный риск тромбофилии имеет место даже при гетерозиготной форме полиморфизма.
Ген F5
Ген F5 кодирует аминокислотную последовательность белка — коагуляционного фактора V (фактор Лейдена). Функция коагуляционного фактора V заключается в активизации реакции образования тромбина из протромбина.
Полиморфизм (1691 G-> A (R506Q)) гена F5 обусловлен заменой нуклеотидного основания гуанина (G) на аденин (A) в положении 1691, что приводит к аминокислотной замене аргинина на глутамин в позиции 506. Замена аминокислоты придаёт устойчивость активной форме фактора Лейдена к расщепляющему действию регулирующего фермента, что приводит к гиперкоагуляции (повышенной свёртываемости) крови. Носители варианта А обладают повышенной склонностью к развитию сосудистых тромбозов, являющихся фактором риска венозных и артериальных тромбоэмболий, инфаркта миокарда и инсульта. Наличие данного варианта полиморфизма несёт серьёзную опасность для беременных, повышает вероятность развития целого ряда осложнений беременности: выкидыша на ранних сроках, отставания развития плода, позднего токсикоза, фетоплацентарной недостаточности и др.
Ген F7
Ген F7 кодирует коагуляционный фактор, который участвует в образовании кровяного сгустка. Вариант 353Gln (10976A) приводит к понижению производительности (экспрессии) гена фактора VII и является защитным фактором в развитии тромбозов и инфаркта миокарда. При исследовании пациентов со стенозом коронарных артерий и инфарктом миокарда обнаружено, что наличие мутации 10976A приводит к понижению уровня фактора VII в крови на 30% и 2-х кратному понижению риска инфаркта миокарда даже при наличии заметного коронарного атеросклероза. В группе пациентов, не имевших инфаркта миокарда, наблюдалась повышенная встречаемость гетеро- и гомозиготных генотипов 10976A, соответственно G/A и G/G.
Ген F13
Ген F13 кодирует фактор XIII. Это фибринстабилизирующий фактор, или фибриназа участвует в образовании нерастворимого фибрина, представляющего собой основу кровяного сгустка, или тромба. Тромбы, образовавшиеся в присутствии фибриназы, очень медленно подвергаются лизису. Повышение активности фактора XIII сопровождается увеличением адгезивности и агрегации кровяных пластинок. У больных с тромбоэмболическими осложнениями активность фибриназы повышена.
Мутация 134Leu наблюдается у 51% женщин с привычным невынашиванием беременности. Риск привычного невынашивания беременности еще выше у лиц — носителей мутации 134Leu в сочетании с мутацией 5G/4G в гене PAI-1.
PAI-1
Ген РАI1 кодирует ингибитор активатора плазминогена — I типа SERPINE1. РАI1 является компонентом противосвёртывающей системы крови. Мутации 5G/4G и 4G/4G приводит к его сверхпродукции. В результате увеличивается риск тромбозов. Гомозиготная мутация 4G/4G является фактором риска для развития тромбозов, в том числе тромбозом портальной вены и тромбозом внутренних органов, и инфаркта миокарда, семейной предрасположенности к ИБС. Также приводит к таким осложнениям беременности, как тяжёлый гестоз (у носительниц генотипа 5G/4G риск увеличивается в 2 раза, а у женщин с генотипом 4G/4G в 4 раза), остановки развития на малых сроках, внутриутробная гибель плода, гипотрофия и задержка внутриутробного развития, хроническая внутриутробная гипоксия плода, преждевременное созревание плаценты.
Назначение специальной профилактики во время беременности: низкодозированная ацетилсалициловая кислота и малые дозы препаратов гепарина позволяет практически полностью устранить риск осложнений беременности у женщин с генотипами 5G/4G и 4G/4G.
Ген ITGB3
Ген ITGB3 кодирует аминокислотную последовательность белковой молекулы тромбоцитарного рецептора фибриногена. Данный рецептор обеспечивает взаимодействие тромбоцитов с фибриногеном плазмы крови, в результате чего происходит агрегация тромбоцитов и образование тромба.
Ген ITGА2
Ген ITGA2 кодирует аминокислотную последовательность a2-субъединицы интегринов — специализированных рецепторов тромбоцитов, за счёт которых происходит взаимодействие тромбоцитов с тканевыми белками, обнажаемыми при повреждении стенки сосудов. Благодаря интегринам тромбоциты образуют монослой в области повреждённых тканей, что является необходимым условием включения последующих звеньев свёртывающей системы крови, предохраняющей организм от кровопотери.
Ген FGB
Ген FGB кодирует аминокислотную последовательность бета-цепи фибриногена. Фибриноген занимает одно из главных мест в свёртывающей системе крови. Из фибриногена образуется фибрин — основной компонент кровяного сгустка.
Нарушения фолатного цикла
Ген MTHFR
Ген MTHFR кодирует аминокислотную последовательность фермента метаболизма гомоцистеина. Гомоцистеин — продукт метаболизма метионина — одной из 8 незаменимых аминокислот организма. Он обладает выраженным токсическим действием на клетку. Циркулируя в крови, гомоцистеин повреждает сосуды, тем самым повышая свёртываемость крови и образование микротромбов в сосудах. Снижение активности метилентетрагидрофолатредуктазы — одна из важных причин накопления гомоцистеина в крови.
Дефицит МТГФР приводит к снижению метилирования ДНК, что приводит к активации многих клеточных генов, в том числе онкогенов. В случае сниженной активности МТГФР во время беременности усиливается влияние тератогенных и мутагенных факторов внешней среды.
Известно около десяти вариантов гена MTHFR, влияющих на функцию фермента. Наиболее изучен полиморфизм 677 C->T (A223V).
Полиморфизм 677 C->T (A223V) связан с заменой в позиции 677 нуклеотида цитозина (С) на тимин (Т). Это приводит к замене аминокислотного остатка аланина на валин в позиции 223, относящейся к участку молекулы фермента, ответственному за связывание фолиевой кислоты. У лиц, гомозиготных по данному варианту (генотип Т/Т) фермент МТГФР проявляет чувствительность к температуре и теряет свою активность примерно на 65%. Вариант Т связан с четырьмя группами многофакторных заболеваний: сердечно-сосудистыми, дефектами развития плода, колоректальной аденомой и раком молочной железы и яичников. У женщин с генотипом Т/Т во время беременности, дефицит фолиевой кислоты может приводить к дефектам развития плода, в том числе, незаращению нервной трубки. У носителей этого генотипа высок риск развития побочных эффектов при приёме некоторых лекарственных препаратов, используемых в раковой химиотерапии, например, метотрексата. Неблагоприятное воздействие варианта Т полиморфизма сильно зависит от внешних факторов — низкого содержания в пище фолатов, курения, приема алкоголя. Сочетание генотипа Т/Т и папилломавирусной инфекции увеличивает риск цервикальной дисплазии. Назначение фолиевой кислоты может значительно снизить риск последствий данного варианта полиморфизма.
Ген MTRR
Ген MTRR кодирует цитоплазматический фермент метионин-синтаза-редуктазу (МСР). Фермент играет важную роль в синтезе белка и участвует в большом количестве биохимических реакций, связанных с переносом метильной группы. Одной из функций МСР является обратное превращение гомоцистеина в метионин.
Ген MTR
Ген MTR кодирует цитоплазматический фермент метионин-синтазу (альтернативное название — 5-метилтетрагидрофолат-гомоцистеин S-метилтрансфераза). Катализирует повторное метилирование гомоцистеина с образованием метионина, в качестве кофактора выступает кобаламин (предшественник витамина В12).
Показания:
- женщинам с первым эпизодом ВТЭ, возникшим во время беременности, в послеродовом периоде, или во время приёма оральных контрацептивов;
- женщинам с необъяснимой внутриутробной гибелью плода во время второго или третьего триместра беременности;
- женщинам с первым эпизодом ВТЭ, получающим заместительную гормональную терапию;
- пациентам, имеющим в анамнезе повторные случаи венозных тромбоэмболий (ВТЭ);
- пациентам с первым эпизодом ВТЭ в возрасте до 50 лет;
- пациентам с первым эпизодом ВТЭ при отсутствии средовых факторов риска в любом возрасте;
- пациентам с первым эпизодом ВТЭ необычной анатомической локализации (мозговых, брыжеечных, печеночных вен, портальной вены и т.д.);
- пациентам с первым эпизодом ВТЭ в любом возрасте, имеющих родственников первой степени родства (родители, дети, сибсы) с тромбозами до 50 лет.
Подготовка
Генетическое обследование не требует специальной подготовки. Рекомендуется взятие крови не ранее чем через 4 часа после последнего приёма пищи.
Перед диагностикой не рекомендуется подвергать себя стрессовым ситуациям, принимать спиртные напитки и курить.
Рацион и приём лекарственных препаратов не влияет на результат исследования.
Интерпретация результатов
Для интерпретации результатов генетического тестирования требуется консультация врача-генетика.
Источник
